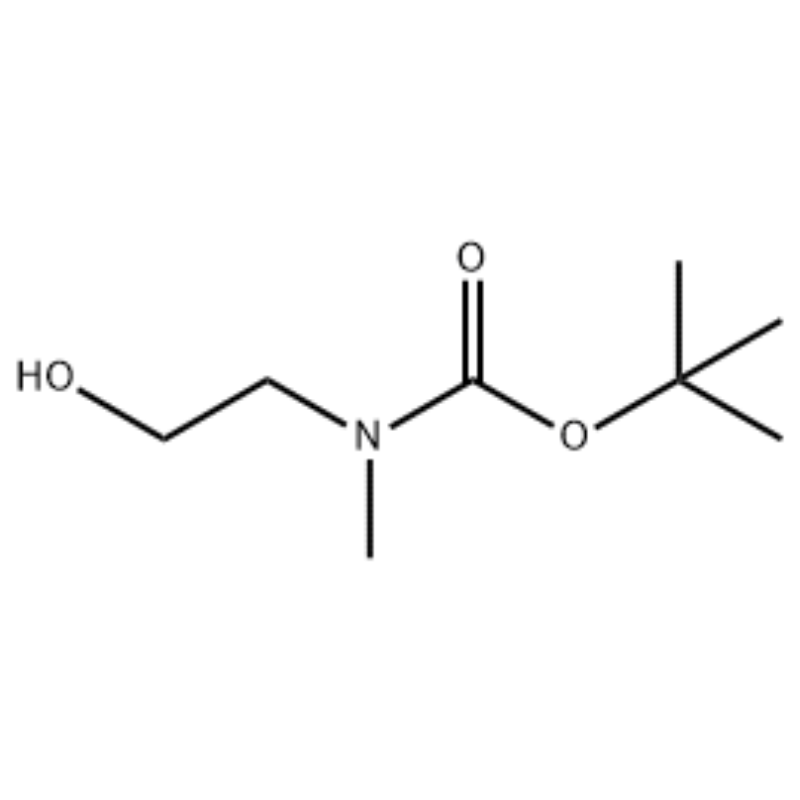
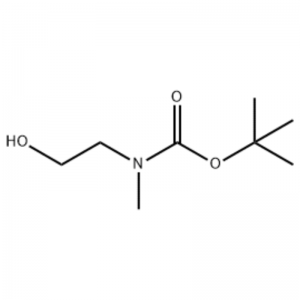
À une solution de 2-(méthylamino)éthanol (500 mg, 0,53 ml, 6,66 mmol) dans du CH2Cl2 (20 ml), du Boc2O (1,48 g, 6,79 mmol) a été ajouté, suivi d'une agitation à température ambiante pendant 1 heure.La solution réactionnelle a été extraite avec de la saumure et du CH2Cl2.La couche organique ainsi obtenue a été séchée sur MgSO4 et filtrée.Ensuite, le filtrat a été concentré sous vide pour obtenir le composé recherché (huile incolore, quantitatif) ;RMN 1H (200 MHz, CDCl3) delta 3,74 (q, J = 10,5, 5,2 Hz, 2H) 3,25 (t, J = 5,2 Hz, 2H) 2,91 (s, 3H) 1,45 (s, 9H) ;spectre de masse m/e (intensité relative) 144 (20) 102 (24) 57 (70) 44 (100).
Exemple 38 ;N1-(3-Fluoro-4-(2-(1-(2-(méthylamino)éthyl)-1H-imidazol-4-yl)thiéno[3,2-b]pyridin-7-yloxy)phényl)-N3 -(2-méthoxyphényl)malonamide (96);Étape 1 : 2-hydroxyéthyl(méthyl)carbamate de tert-butyle (97) (J. Med. Chem., 1999, 42, 11, 2008) Dans une solution de 2-(méthylamino)éthanol (5,0 g, 67 mmol) dans Du THF (50 ml) à température ambiante a été ajouté, du Boc2O (15,7 g, 72 mmol) et le mélange réactionnel a été agité à température ambiante pendant 4 heures.Le mélange réactionnel a été concentré à sec et le composé du titre 97 a été utilisé directement dans l'étape suivante sans purification supplémentaire (11,74 g, rendement de 100 %).MS (m/z) : 176,2 (M+H).
Préparation de la l-2-[4-Bromo-2-(4-oxo-2-ftiotaioxo1hiazolidin-5-ylidènemefliyl)phénoxy]efliyl-3-efliyl-l- méthylurée (Compoiotamd 161)Étape 1 : Synthèse du t-butyl2- l'hydroxyéthylméthylcarbamate;À une solution de 2-(méthylamino)éthanol (500 mg, 0,53 ml, 6,66 mmol) dans du CH2Cl2 (20 ml), on a ajouté du BoC2O (1,48 g, 6,79 mmol), suivi d'une agitation à température ambiante pendant 1 heure.La solution réactionnelle a été extraite avec de la saumure et du CH2Cl2.La couche organique ainsi obtenue a été séchée sur MgSO4 et filtrée.Ensuite, le filtrat a été concentré sous vide pour obtenir le composé objet (huile incolore, quantitatif) ; 1HNMR (200 MHz, CDCl3) delta 3,74 (q, J= 10,5, 5,2 Hz, 2H) 3,25 (t, J= 5,2 Hz, 2H) 2,91 (s, 3H) 1,45 (s, 9H);spectre de masse m/e (intensité relative) 144 (20) 102 (24) 57 (70) 44 (100).
Du 2-(méthylamino)éthanol (90,1 g, 1,2 mole) a été dissous dans 1,2 L de chlorure de méthylène et du BoC2O (218 g, 1 mol) y a été lentement ajouté sous agitation à 0 °C, puis à température ambiante pendant 3 heures.Le mélange réactionnel a été lavé successivement avec 700 ml d'une solution aqueuse de chlorure d'ammonium saturé et 300 ml d'eau.Le mélange lavé a été déshydraté à l'aide de sulfate de sodium anhydre et concentré sous pression réduite pour obtenir le composé (a) (175 g, 1 mole, 100 %) sous la forme d'une huile incolore. CCM : Rf = 0,5 (50 % d'EtOAc dans Hex) visualisé avec Ce-Mo coloration1H RMN (600 MHz, CDCl3) delta 1,47 (s, 9H), 2,88 (br s, IH), 3,41 (br s, 2H), 3,76 (br s, 2H).
90,1 g (1,2 mole) de 2-(méthylamino)éthanol ont été dissous dans 1,2 L de chlorure de méthylène, 218 g (1 mole) de Boc2O y ont été lentement ajoutés pendant que la solution résultante était agitée à 0 °C, et la solution résultante était agitée à 0 °C. température ambiante pendant 3 heures.Le mélange réactionnel a été lavé successivement avec 700 ml d'une solution aqueuse saturée de chlorure d'ammonium et 300 ml d'eau, déshydraté à l'aide de sulfate de sodium anhydre, puis concentré sous pression réduite pour obtenir 175 g (1 mole) d'un composé huileux achromique protégé par le Groupe Boc (rendement : 100%).RMN 1H (600 MHz, CDCl3) delta 7,84 (br s, 2H), 7,76 (br s, 2H), 4,34 (d, J = 15,0 Hz, 2H), 3,63 (br s, 2H), 3,04 (d , J = 15,0 Hz, 3H), 1,46 (d, J = 16,2 Hz, 9H) [0141] 90 g (0,514 mol) du composé obtenu ont été dissous dans 1,5 L de tétrahydrofurane, 88,0 g (539 mol) de N- de l'hydroxyphtalimide et 141 g (0,539 mole) de triphénylphosphine y ont été ajoutés, 106 ml (0,539 mole) d'azodicarboxylate de diisopropyle y ont été lentement ajoutés tout en agitant la solution résultante à 0 °C, et la solution résultante a été agitée pendant 3 heures tandis que sa température était augmentée. à température ambiante.Après concentration du mélange réactionnel sous pression réduite, 600 ml d'éther isopropylique y ont été ajoutés, la solution résultante a été agitée à 0 °C pendant 1 heure et l'oxyde de triphénylphosphine de type solide blanc a été filtré.Le solide a été lavé avec 200 ml d'éther isopropylique refroidi à 0 °C et collecté avec le premier filtrat, et le filtrat résultant a été concentré sous pression réduite pour obtenir 198 g d'un mélange de composé XX et d'hydrazodicarboxylate de diisopropyle dans un rapport de mélange de 10 à 15 %. (rendement : 120%).RMN 1H (600 MHz, CDCl3) delta 7,84 (br s, 2H), 7,76 (br s, 2H), 4,34 (d, J = 15,0 Hz, 2H), 3,63 (br s, 2H), 3,04 (d , J = 15,0 Hz, 3H), 1,46 (d, J= 16,2 Hz, 9H)
 Bâtiment 12, n° 309, 2e route sud, zone de développement économique, district de Longquanyi, Chengdu, Sichuan, Chine.
Bâtiment 12, n° 309, 2e route sud, zone de développement économique, district de Longquanyi, Chengdu, Sichuan, Chine. amy@enlaibio.com / cynthia@enlaibio.com / edison@enlaibio.com / daisy@enlaibio.com
amy@enlaibio.com / cynthia@enlaibio.com / edison@enlaibio.com / daisy@enlaibio.com +86 (028) 84841969
+86 (028) 84841969 +86 135 5885 5404
+86 135 5885 5404



















.png)


